不同于传统三质粒感染系统,One-Bac 4.0系统作为昆虫杆状病毒系统,其生产过程包括:杆状病毒质粒构建--毒种生产--毒种扩增--毒种感染昆虫细胞--AAV收获,几个主要部分。通过含有AAV基因组的杆状病毒感染昆虫细胞,实现生产的线性化放大,突破AAV大规模制备的壁垒。单批次产能远超其他系统,有望惠及更多病患。
劲帆医药已完成多个项目的交付,部分案例数据展示如下。
● 高安全性
One-Bac 4.0系统⽣产的AAV杂质少,⽆rcAAV残留。
|
One-Bac 4.0 |
||||
|
Feature |
Illumina |
PacBio |
||
|
Reads |
Ratio |
Reads |
Ratio |
|
|
Total reads |
6.45×107 |
100.00% |
9.22×104 |
100.00% |
|
rAAV |
6.39×107 |
99.12% |
9.17×104 |
99.49% |
|
Baculovirus |
2.35×105 |
0.36% |
1.77×102 |
0.19% |
|
HCD |
5.15×103 |
0.01% |
2 |
0.00% |
|
Chimeric events |
N/A |
N/A |
1.50×102 |
0.16% |
|
Unmapped |
3.24×105 |
0.50% |
1.44×102 |
0.16% |
|
HEK293 |
||||
|
Feature |
Illumina |
PacBio |
||
|
Reads |
Ratio |
Reads |
Ratio |
|
|
Total reads |
7.08×107 |
100.00% |
6.53×104 |
100.00% |
|
rAAV |
6.83×107 |
96.44% |
5.51×104 |
84.44% |
|
Plasmid backbone |
1.98×106 |
2.79% |
5.53×103 |
8.47% |
|
HCD |
1.62×105 |
0.23% |
4.84×102 |
0.74% |
|
Chimeric events |
N/A |
N/A |
4.13×103 |
6.33% |
|
Unmapped |
3.81×105 |
0.54% |
9 |
0.01% |
经Illumina与PacBio测序验证,Bac/Sf9⽣产的AAV纯度⾼。

对三轮细胞培养后细胞培养液提取基因组DNA并针对rcAAV进行qPCR检测,100IU的阳性对照样品(wtAAV2/9)三轮扩增Ct呈下降趋势,说明其rcAAV经过培养得到了扩增;Sf9系统生产的rAAV2/9,接毒量1E+12vg,三轮扩增中Ct无下降,且Ct与阴性对照(NC)相近,未检测到rcAAV;HEK293系统生产的rAAV2/9,接毒量1E+10vg,三轮扩增中Ct也呈现下降趋势,说明其rcAAV经过培养也得到了扩增,检测到了rcAAV。
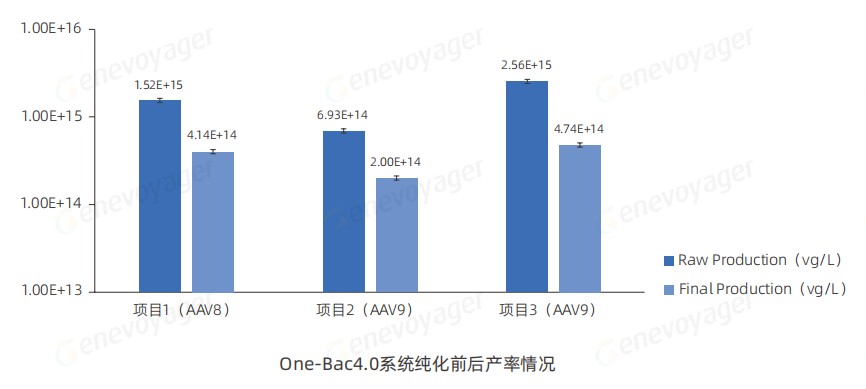
● 高产率
50L生产规模下,One-Bac 4.0系统生产的不同血清型AAV纯化前后均保持较高产率。
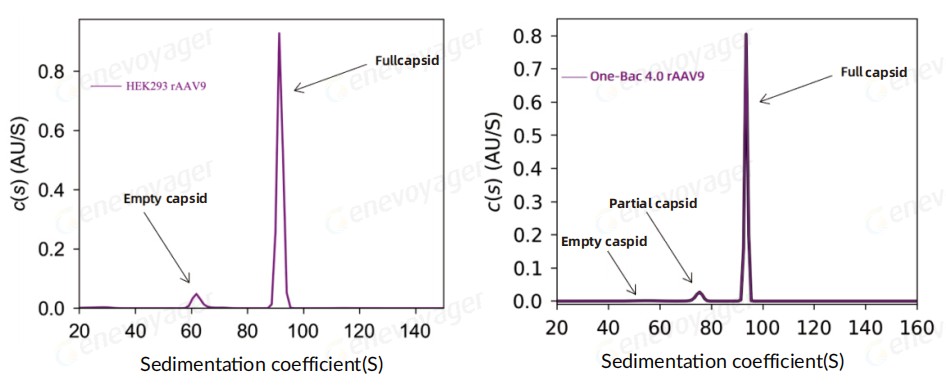
● 高实心率
One-Bac 4.0系统终产品AAV实心率较⾼,可达90%以上。
制备工艺
产物状态
纯化方式
AUC % empty
AUC % partial
AUC % full
AUC % aggregates
劲帆HEK293
终产品
亲和+阴离子
7.52
0
>90
0.16
One-Bac 4.0
终产品
亲和+阴离子
1.1
7.2
>90
0
● 高感染活性
细胞及动物实验结果表明,One-Bac 4.0系统生产的AAV感染效果较好。
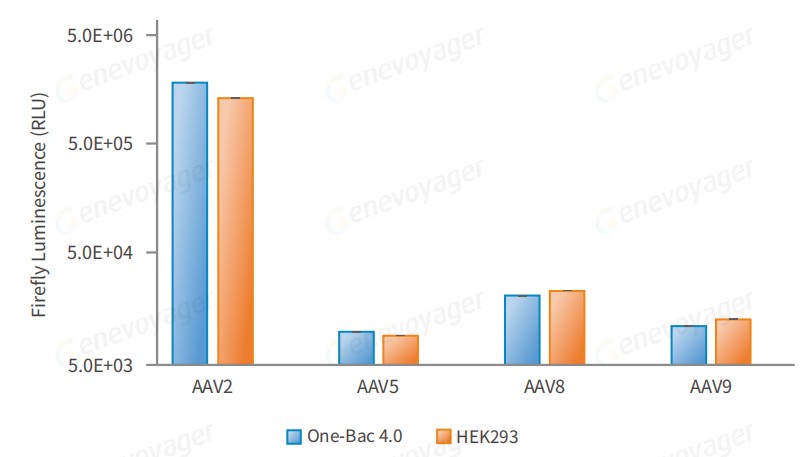
One-Bac 4.0系统与HEK293系统⽣产不同⾎清型AAV-Luc相同MOI感染HEK293细胞表达萤⽕⾍荧光素酶活性⽐较。

One-Bac4.0系统与HEK293系统生产rAAV9-EGFP、rAAV9-mCherry转导能力【比活:物理滴度/感染滴度(TCID5)】比较。
● BEV传代稳定性
One-Bac 4.0系统采用的杆状病毒表达载体(Baculovirus Expression Vector, BEV)在多代次内的传代稳定性高,确保大规模生产时,AAV批次间高产率和高病毒活性的特
征不变。

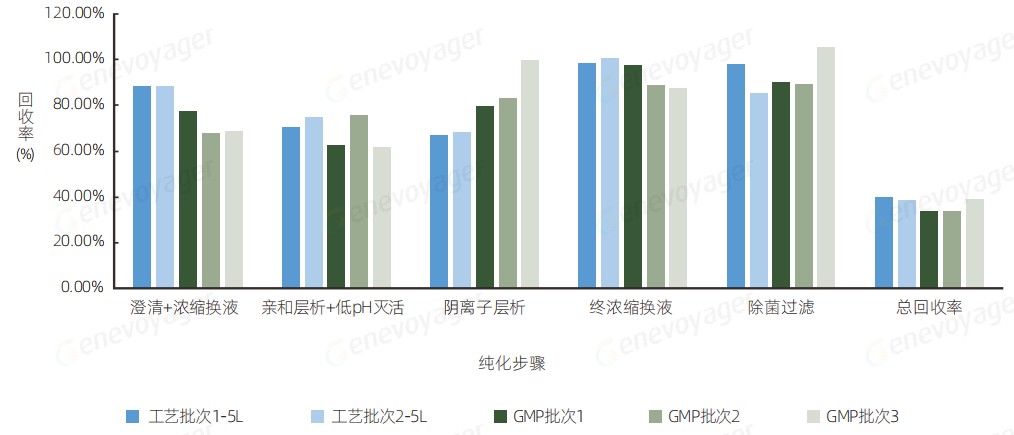
● 高回收率
One-Bac 4.0系统在从5L到200L的放⼤过程中,始终保持≥30%的稳定回收率,展现出良好的⼯艺放⼤性与规模化⽣产效率。
● 高浓度低聚集
One-Bac 4.0系统⽣产的AAV在⾼浓度条件下聚集⽔平低,具备良好的储存稳定性和冻融耐受性。
|
4℃和27℃下的稳定性(AAV9) |
||||
|
孵育条件 |
检测结果 |
|||
|
温度 |
天数(D) |
ddPCR-GOI(vg/mL) |
Main peak SEC-HPLC(%) |
DLS |
|
成分直径(nm) |
||||
|
对照组 |
0 |
2.76E+14 |
96.18 |
31.76 |
|
4℃ |
7 |
2.84E+14 |
95.80 |
33.20 |
|
14 |
2.69E+14 |
95.51 |
33.70 |
|
|
27℃ |
3 |
2.86E+14 |
95.91 |
31.11 |
|
7 |
2.49E+14 |
95.70 |
31.98 |
|
|
14 |
2.84E+14 |
94.60 |
30.32 |
|
|
-80℃冻融稳定性(AAV9) |
||||
|
处理条件 |
检测结果 |
|||
|
ddPCR-GOI(vg/mL) |
Main peak SEC-HPLC(%) |
DLS |
||
|
成分直径(nm) |
||||
|
对照 |
2.76E+14 |
96.18 |
31.76 |
|
|
冻融3次 |
2.98E+14 |
95.05 |
31.15 |
|
|
冻融5次 |
2.64E+14 |
94.12 |
32.12 |
|
此外,One-Bac 4.0系统⽣产的AAV⽆rcAAV残留,纯度⾼、表达强,兼顾安全性与疗效。
● 高可及性
One-Bac 4.0系统生产过程无需GMP质粒及高成本转染试剂,极大降低了AAV大规模生产的原料成本。

● 短交付周期
种毒库的建立,使得病毒生产的种毒感染过程变得快速简便,且该特点随着病毒需求规模的增大愈发明显,极大缩短病毒生产交付周期。
包装系统
II期(50人份)
II期(200人份)
上市(3000人份)
劲帆One-Bac 4.0系统
500L发酵
2000L发酵
5000L发酵
500L纯化
2000L纯化
5000L纯化
检测
检测
检测
总计
10-12周
12-14周
14-15周
HEK293无血清悬浮系统
制备3种质粒
——
——
500~1000L发酵
——
——
1000L纯化
——
——
检测
——
——
总计
18-20周
不易实现
不易实现

地址:中国武汉东湖高新区光谷七路128号 市场:17720522078 人事行政:027-62439686 邮箱:marketing@genevoyager.com
BD 商务总台:17720514121 /13886000399(BD 经理) /17720515371(BD 经理)
本公司所有产品仅供实验科研使用,不用于人体疾病治疗及临床诊断。