2023-11-03
溶瘤病毒
溶瘤病毒(oncolytic viruses,OVs)疗法是一类新兴的癌症治疗方法,能在肿瘤细胞中选择性复制、传递多种治疗基因、诱导免疫原性细胞死亡和促进抗肿瘤免疫,同时具有可耐受的安全性,在很大程度上不与其他癌症治疗药物发生交叉耐药。迄今为止,全球已批准四种OVs和一种非溶瘤病毒用于治疗癌症。用于治疗黑色素瘤的talimogene laherparepvec(T-VEC,又称为IMLYGIC)是目前唯一受到广泛认可的OVs产品,已在多个国家/地区上市。T-VEC是一种经过工程改造的1型溶瘤单纯疱疹病毒(HSV1),可在肿瘤细胞中优先复制并诱导抗肿瘤免疫反应。自2015年首次获批以来,T-VEC已在许多其他临床试验中进行了测试,包括与其他疗法联合治疗黑色素瘤和作为单一疗法治疗各种其他癌症等,这些研究为如何更好地将T-VEC纳入黑色素瘤的临床治疗提供了新的见解。
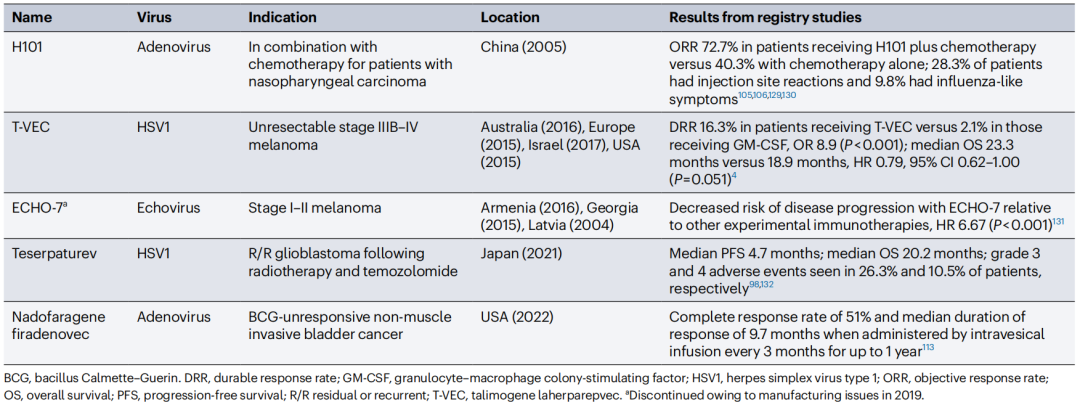
表1 目前全球已批准的溶瘤和非溶瘤病毒产品
(数据来源:Shalhout SZ et al., Nat Rev Clin Oncol, 2023)
近日,来自哈佛医学院的Howard L. Kaufman研究团队在Nature Reviews Clinical Oncology上发表了题为“Therapy with oncolytic viruses: progress and challenges”的综述,总结了T-VEC的临床经验,并就如何在临床实践中优化OVs的使用提供指导;介绍了目前处于临床开发阶段的新型OVs的数据;讨论了OVs在临床前开发、临床试验及监管方面面临的众多挑战。
1. 临床开发
1.1 T-VEC的作用机制
通过直接注射T-VEC到黑色素瘤病灶中,可造成肿瘤细胞的溶解,导致肿瘤细胞死亡。同时它所表达的人类粒细胞-巨噬细胞集落刺激因子(GM-CSF)蛋白能够有效的聚集树突状细胞,从而增加抗原递呈,以引起周边CD4+、CD8+T细胞的免疫反应,继而对肿瘤细胞起到破坏的作用,形成一个消灭癌细胞的正循坏。
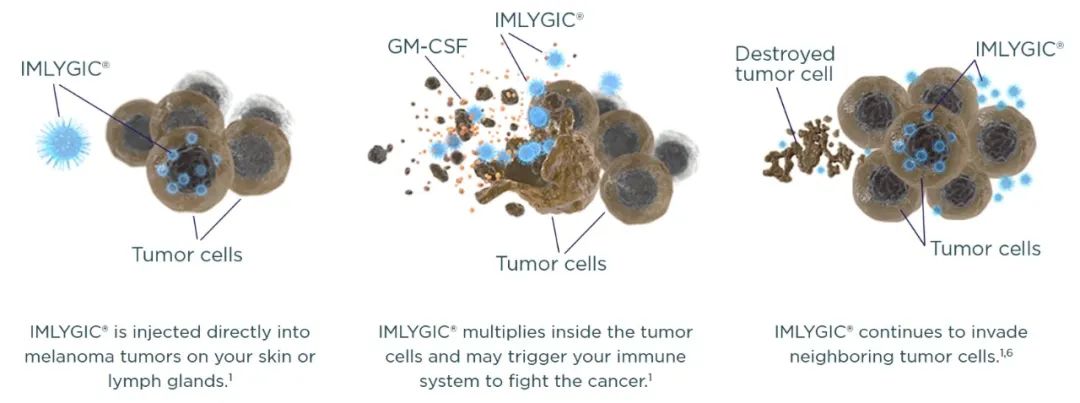
图1 T-VEC治疗复发黑色素瘤的原理
(图片来源:https://www.imlygic.com)
1.2 T-VEC的临床研究
T-VEC的首次人体I期临床试验旨在评估瘤内注射的安全性及最佳给药方案。该试验招募了30名诊断为乳腺癌、黑色素瘤、头颈癌和结直肠癌且标准治疗无效的患者。数据显示T-VEC总体耐受性良好,最常见的不良反应为疲劳、恶心、发热、寒颤和注射部位疼痛,多数为轻度至中度(1-2级)。有效给药方案包括:初始时,注射106PFU/mL;3周后,每2周注射108PFU/mL的剂量。该研究还建立了以肿瘤体积为标准的药物体积滴定方法,即所有病灶单次注射总剂量不得超过4mL,注射量根据肿瘤最长直径来确定。该方案也在后续的临床试验中沿用。
在Ⅰ期临床研究之后,研究人员进行了一项开放标签、单臂、多中心临床试验,以确定T-VEC对50名无法切除的晚期黑色素瘤患者的疗效,主要终点为客观缓解率(objective response rate,ORR)。10名患者完全缓解(complete response,CR),3名患者部分缓解(partial response,PR;ORR 26%),中位数为6次T-VEC注射。
基于这些结果,开展了一项开放标签、随机Ⅲ期OPTiM试验,旨在评估T-VEC的疗效。该试验纳入了436名ⅢB/C-Ⅳ期黑色素瘤患者,比较了T-VEC与瘤内注射重组GM-CSF的疗效。主要终点为持续缓解率(durable response rate,DRR,WHO定义为疗效持续6个月以上)。在初步分析中,T-VEC组达到了主要终点,与GM-CSF组相比,DRR有显著改善(16.3% vs 2.1%)。接受T-VEC治疗的患者ORR为26.4%,而接受GM-CSF治疗的患者ORR为5.7%。
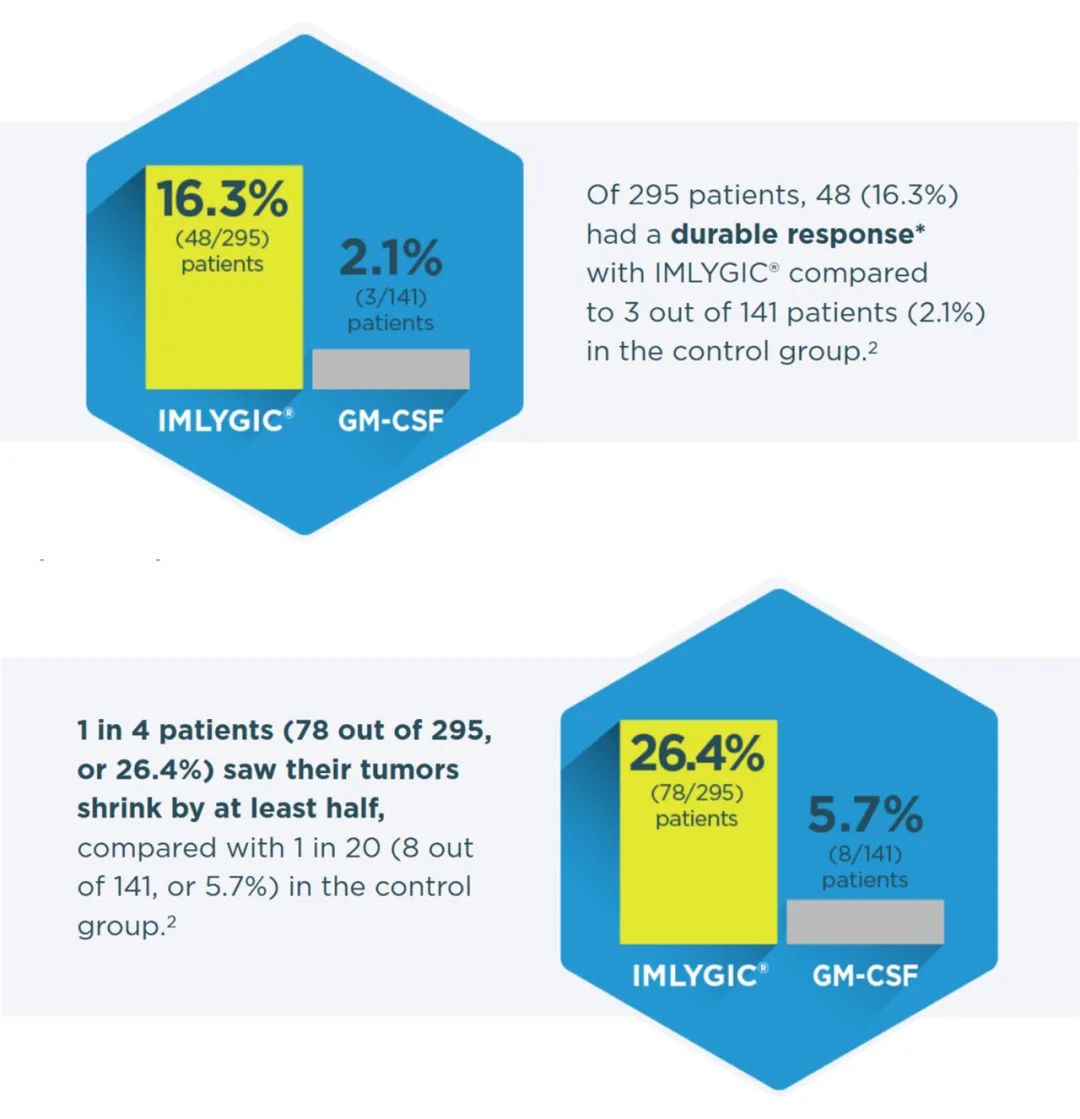
图2 T-VEC临床试验结果
(图片来源:https://www.imlygic.com)
在最终分析中,接受T-VEC治疗的患者DRR也增加到19%,而接受GM-CSF治疗的患者DRR仅为1.4%。此时,T-VEC组的ORR为31.5%,其中CR率16.9%的,可能反映了部分患者对治疗的延迟反应。与先前的研究类似,T-VEC显示出可耐受的安全性,最常见的不良反应是低度疲劳、发热和寒颤。基于这些积极的临床数据,T-VEC于2015年获FDA批准上市,随后也在澳大利亚和以色列获批。
在欧洲,T-VEC也被批准用于Ⅲ-ⅣM1a期患者,其依据是一项亚组分析。数据显示,在这些亚组中,与GM-CSF组相比,T-VEC组的DRR和ORR改善更为显著(Ⅲ期患者的DRR为33% vs 0%,ⅣM1a期患者的DRR为24% vs 0%)。在接受T-VEC治疗的Ⅲ-ⅣM1a期患者中,总生存期(overall survival,OS)的差异尤为明显(46.8 months vs 21.5 months)。
在过去的5年里,评估T-VEC在晚期黑色素瘤患者中活性的临床报告证实了关键试验中报告的安全性和有效性结果。例如,一项多机构观察性研究对80名患者进行了T-VEC的真实世界安全性和有效性评估。T-VEC的安全性与关键试验报告中的描述相当,观察到的ORR为57%,其中CR率为39%。观察得到的较高缓解率可能反映了这样一个事实,即研究人员通常选择无法切除的Ⅲ期肿瘤患者,包括发生移行转移(in-transit metastases)的患者。在另一项多中心回顾性研究中,76名晚期黑色素瘤患者接受了T-VEC治疗,其中42名ⅢB-ⅣM1a期患者的12个月OS为77%,30名ⅣM1b-ⅣM1c期患者的12个月OS为64.6%。一项涉及欧洲多地66名患者的多机构研究数据表明,55.3%接受T-VEC治疗的患者因不再出现病变而停止治疗。不同国家在患者选择方面存在一些差异,作者得出的结论是,接受一线治疗的早期Ⅲ期患者是最佳应答者。另一项多机构研究评估了同时或依次接受T-VEC与抗PD-1抗体治疗的患者的回顾性数据,发现临床结果和安全性方面没有明显差异,这表明T-VEC可以安全地与免疫检查点抑制剂(immune-checkpoint inhibitors,ICI)联用,或在ICI之后使用。一项国际多中心研究纳入了112名ⅢB-Ⅳ期黑色素瘤患者,这些患者在接受ICI治疗后病情恶化,并接受了T-VEC治疗,基于所有直接注射部位的评估,37%的患者完全缓解,14%的患者部分缓解。综上所述,这些数据表明,T-VEC在常规临床实践中的耐受性与前瞻性研究中观察到的结果一致。尽管有一些理论上的担忧,但没有出现家庭之间传播或环境传播的报告。此外,ORR普遍高于临床试验中报告的数据,这可能反映了T-VEC在一线治疗中普遍用于早期病变患者。
T-VEC除了用于黑色素瘤之外,也在积极拓宽其它的新适应症。例如今年2月,T-VEC在三阴性乳腺癌临床试验中取得积极进展。在这项Ⅱ期试验中,37名三阴性乳腺癌患者在手术前接受T-VEC联合标准化疗,其中45.9%的患者(17/37)在治疗后完全缓解,且在治疗后两年内,89%的患者没有复发。
此外,基于OVs的抗肿瘤机制和安全性,将OVs与其它治疗手段联合使用也极具开发价值。下文将详细介绍OVs与其它疗法联用的进展。
2. OVs用于新辅助治疗
临床数据显示,在多种癌症的新辅助治疗中使用免疫检查点阻断剂可以产生明显的临床反应。在Southwest Oncology Group(SWOG)S1801研究中,313名可切除Ⅲ-Ⅳ期黑色素瘤患者被随机分配接受新辅助或辅助帕博利珠单抗治疗。结果显示,接受3次新辅助帕博利珠单抗治疗后接受辅助帕博利珠单抗治疗的患者2年无事件生存率(event free survival,EFS)为72%,而仅接受辅助帕博利珠单抗治疗的患者为49%。新辅助免疫治疗的这种明显优势存在一些争议,尽管如此,新辅助免疫疗法仍有应用潜力,但在临床评估和实施方面也具有挑战性。
OVs可能适合用于新辅助治疗,因为它能够诱导“原位”疫苗接种效应,从而允许个性化地诱导肿瘤特异性免疫反应,还可能诱导T细胞浸润到具有免疫排斥或免疫沙漠表型的肿瘤中。一项开放标签、随机Ⅱ期试验对新辅助T-VEC的疗效进行了评估,该试验纳入了150名可切除的ⅢB-ⅣM1a期黑色素瘤患者,主要终点是2年无复发生存率(recurrence-free survival,RFS)。在这项研究中,76名患者被随机分配接受6剂T-VEC治疗,随后进行手术,74名患者被分配接受单纯手术治疗。结果显示,T-VEC组患者的2年RFS为29.5%,而单纯手术组患者为16.5%。在2年随访期间,次要终点OS在T-VEC组中也有所改善。在3年随访期间,RFS和OS的差异仍然存在。接受T-VEC治疗的患者病理学完全缓解率为17%,且肿瘤部位CD8+ T细胞密度增加。在这项试验中接受新辅助T-VEC治疗的患者疾病复发风险降低了25%,达到了主要终点。该研究提示,对于肿瘤边缘可切除的患者,可以考虑接受短期新辅助T-VEC治疗。
3. 联合疗法
OVs的抗肿瘤机制与其他疗法截然不同,且毒性作用有限,因此OVs是与大多数其他疗法联用的理想疗法,包括全身化疗、免疫疗法、靶向疗法及放疗。研究表明,OVs与其他全身性疗法(包括化疗和细胞疗法)联用时,其抗肿瘤活性得到增强。此外,OVs可以作用于肿瘤微环境,促进PD-1和PD-L1的表达,逆转ICIs的耐药性。OVs和ICIs潜在的协同作用也已在动物模型中得到证实。
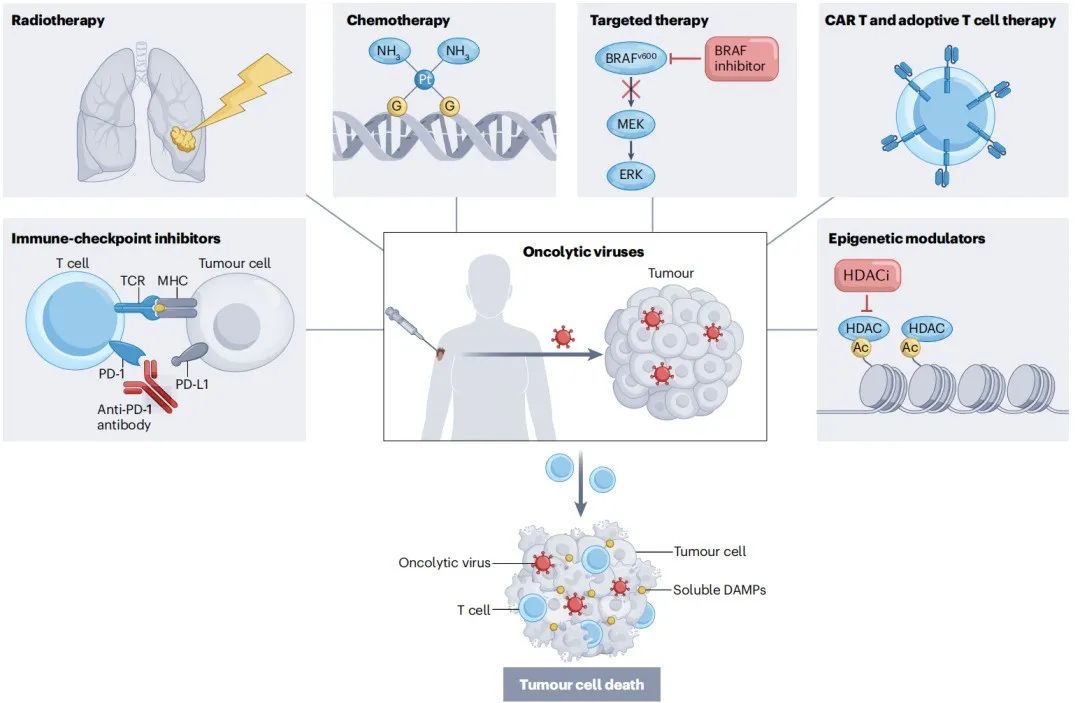
图3 临床开发中潜在的OVs联合疗法(图片来源:Shalhout SZ et al., Nat Rev Clin Oncol, 2023)
3.1 OVs联合ICIs
在一项纳入19名晚期黑色素瘤患者的Ⅰ期临床试验中,对T-VEC联合ipilimumab的疗效进行了评估,结果显示ORR为50%,比ipilimumab或T-VEC单独治疗的缓解率更高。随后进行了一项随机Ⅱ期临床试验,在198名转移性黑色素瘤患者中比较了T-VEC+ipilimumab与ipilimumab单药治疗的疗效。结果表明,T-VEC+ipilimumab组患者的ORR为39%,而ipilimumab单药治疗组为18%。联合用药相比于单药治疗的毒性也没有明显增加。
在另一项Ⅰb期试验中,探索了T-VEC与抗PD-1抗体pembrolizumab联用的疗效,结果显示,21名晚期黑色素瘤患者的ORR为62%。研究中,在给予pembrolizumab之前给予两次T-VEC,从而增加了肿瘤微环境中局部PD-L1的表达和CD8+T细胞浸润。值得注意的是,某些基线未检测到的T细胞浸润或炎症基因特征的肿瘤患者仍然达到完全缓解,这表明T-VEC促进了对ICIs的反应性。这些数据为MASTERKEY-265研究提供了理论依据。在MASTERKEY-265 Ⅲ期临床研究中,692名ⅢB-ⅣM1c期黑色素瘤患者按1:1随机分配接受T-VEC+pembrolizumab或安慰剂+pembrolizumab治疗。从数值上看,联合治疗组的缓解率更高(ORR 48.6% vs 41.3%),然而,这项研究未能达到PFS和OS这两个主要终点。MASTERKEY-265试验失败的原因可能与统计能力不足、pembrolizumab给药时间与Ⅰ期临床试验有差异相关。
除T-VEC外,其他OVs与ICI联用的研究也正在开展,包括单纯疱疹病毒、呼肠孤病毒、痘病毒、柯萨奇病毒和腺病毒。
3.2 OVs联合CAR-T细胞疗法
OVs能够在释放细胞因子(如TNF、IL-2和IL-15)以及趋化因子(如CXCL9和CXCL10)时促进T细胞向肿瘤募集。在胶质母细胞瘤小鼠模型中进行了IL-7编码的溶瘤腺病毒与靶向B7H3的CAR-T细胞相结合的临床前研究。在体内外都观察到这种方法的协同抗癌活性。同样,在三阴乳腺癌小鼠异种移植模型中,研究了间皮素特异性CAR T细胞联合溶瘤腺病毒疗法,观察到该组合具有快速的抗肿瘤活性并能促进癌细胞死亡。这些研究表明,OVs是一种具有潜力的治疗策略,可增强CAR T细胞疗法在实体瘤中的疗效。目前,一项将溶瘤腺病毒与HER2特异性CAR T疗法相结合的临床研究(NCT03740256)正在进行中。
3.3 OVs联合放疗
有证据表明,OVs与放疗相联用时可能会促进远隔效应的发生。放疗可能会增加病毒复制和细胞间传播,增加抗原呈递,而其他研究数据表明,病毒感染后DNA修复抑制的重叠机制可能很重要。在BRAFV600E/D突变型黑色素瘤小鼠模型中,测试了基因改造的溶瘤痘病毒和放疗的联合疗法。在这项研究中,联合疗法促进了肿瘤细胞死亡,包括诱导半胱天冬酶活性,导致体内肿瘤消退。尽管一种表达人端粒酶逆转录酶启动子的溶瘤腺病毒OBP-301在13名不能耐受标准治疗的食管癌患者中表现出良好的安全性和积极的治疗效果(通过内窥镜进行瘤内注射,同时接受放疗),但这种方法的临床经验目前仍有限。此外,T-VEC联合放疗目前正在可手术切除的软组织肉瘤患者(NCT02453191)以及黑色素瘤和其他实体瘤患者(NCT02819843)中进行试验。
3.4 OVs联合化疗
传统的细胞毒性药物,如DNA嵌入剂、核苷酸类似物或烷化剂,也正在考虑与OVs联合使用。化疗被认为能直接针对快速分裂的细胞,因此,将化疗和OVs联合使用可能会导致更好的治疗反应。已经报道了支持这一假设的初步数据。例如,将docetaxel与编码IL-24的溶瘤腺病毒ZD55-IL-24联用进行的体内外研究数据表明,与单独使用ZD55-IL-24或放射治疗的肿瘤组织相比,小鼠前列腺癌异种移植模型中caspase 3和caspase 8的表达显著增加,凋亡程度显著增加。此外,几项涉及小鼠模型的临床前研究数据表明,预先暴露于环磷酰胺可增强几种OVs的效力。因此,在给予OVs之前进行化疗可能是最佳方法。目前关于OVs和细胞毒性药物联合使用的临床数据有限。在一项纳入17名头颈部鳞状细胞癌患者的Ⅱ期临床试验中,T-VEC联合放化疗使14名(82.3%)患者达到了RECIST(Response Evaluation Criteriain Solid Tumors)定义的缓解,15名接受手术的患者中有14名(93.3%)达到病理学CR。
3.5 OVs联合靶向疗法
与抑制所有快速分裂细胞的全身性化疗相比,分子靶向疗法可抑制具有高度特异性突变的肿瘤细胞,提供了一种个性化的治疗策略。例如,在BRAFV600E突变型黑色素瘤患者中,BRAF/MEK靶向治疗的反应率通常较高(约60-70%),但初始治疗后往往会出现获得性耐药。因此,目前靶向治疗联合OVs的治疗策略正在探索中。一些研究小组已经报告了T-VEC和BRAF/MEK抑制剂在黑色素瘤和甲状腺癌小鼠模型中的联合治疗。一项临床前研究已经证明,在胰腺癌小鼠异种移植模型中,溶瘤HSV1 HF10与EGFR酪氨酸激酶抑制剂erlotinib联用具有持久性和抗肿瘤活性。Cetuximab是一种抗EGFR单克隆抗体,与溶瘤HSV1联合使用时对人CRC细胞具有协同活性。
OVs联合疗法的临床前研究数据为临床试验的开展提供了相当大的支持。然而,到目前为止,临床转化仍具有挑战性。需要进一步的机制研究以充分了解各种治疗组合如何介导抗肿瘤活性。此外,需要预测性生物标志物来指导临床开发。
4. 临床开发面临的挑战
4.1 临床前挑战
4.1.1 小鼠模型
许多哺乳动物病毒的细胞嗜性具有高度限制性,这限制了人用的OVs在小鼠模型中的测试。免疫缺陷小鼠品系能够使用人源的癌细胞,并可能克服同源小鼠模型的局限性。然而,这种免疫缺陷动物模型通常不适用于涉及活的复制型病毒的研究。对于这类研究,具有完整适应性免疫系统的免疫功能健全的宿主通常是首选。某些人源化小鼠模型可能是研究OVs的理想动物模型,但也可能缺乏某些特定的细胞类型和/或分子元素,无法充分理解OVs如何与人类免疫系统相互作用。此外,人源化小鼠模型可用于仅在人类肿瘤细胞中复制的病毒,但人源化小鼠模型价格昂贵、耗费大量人力和时间,而且对患者血液匹配的需求带来了进一步的挑战。特别是,许多人源化小鼠模型需要HLA匹配和人类免疫细胞移植,这些都具有挑战性。
4.1.2 动物模型的肿瘤微环境
另一个局限性是,大多数OVs临床前研究使用皮下肿瘤来简化给药,这些模型并不能提供准确的肿瘤微环境,通常也不能反映多发性转移病灶患者的疾病特征。原位小鼠模型可能提供更合适的肿瘤部位和相似的微环境,虽然在这些模型中将病毒引入肿瘤部位可能更具挑战性。患者来源的异种移植小鼠模型在适应小鼠微环境方面提供了更准确的遗传背景,但通常也有较长潜伏期(约75天) 。无论使用哪种动物模型,缺乏对体外效应量化的标准化评估标准,进一步阻碍了准确的体内临床前试验。开发更相关和复杂的小鼠模型,能够对OVs的耐药和敏感性机制进行详细研究,将改善这些疗法的发展。
4.1.3 抗病毒免疫
OVs可以作为原位癌症疫苗,通过诱导ICD,释放可溶性肿瘤相关抗原、损伤相关模式分子和病原体相关模式分子。原位接种的成功取决于抗病毒免疫反应的激活程度。如果这种反应过强烈,可能会导致病毒迅速清除,从而限制抗肿瘤免疫的诱导。因此,使用OVs实现最佳的肿瘤消退,取决于在抗病毒免疫反应和抗肿瘤免疫反应之间找到最佳平衡。
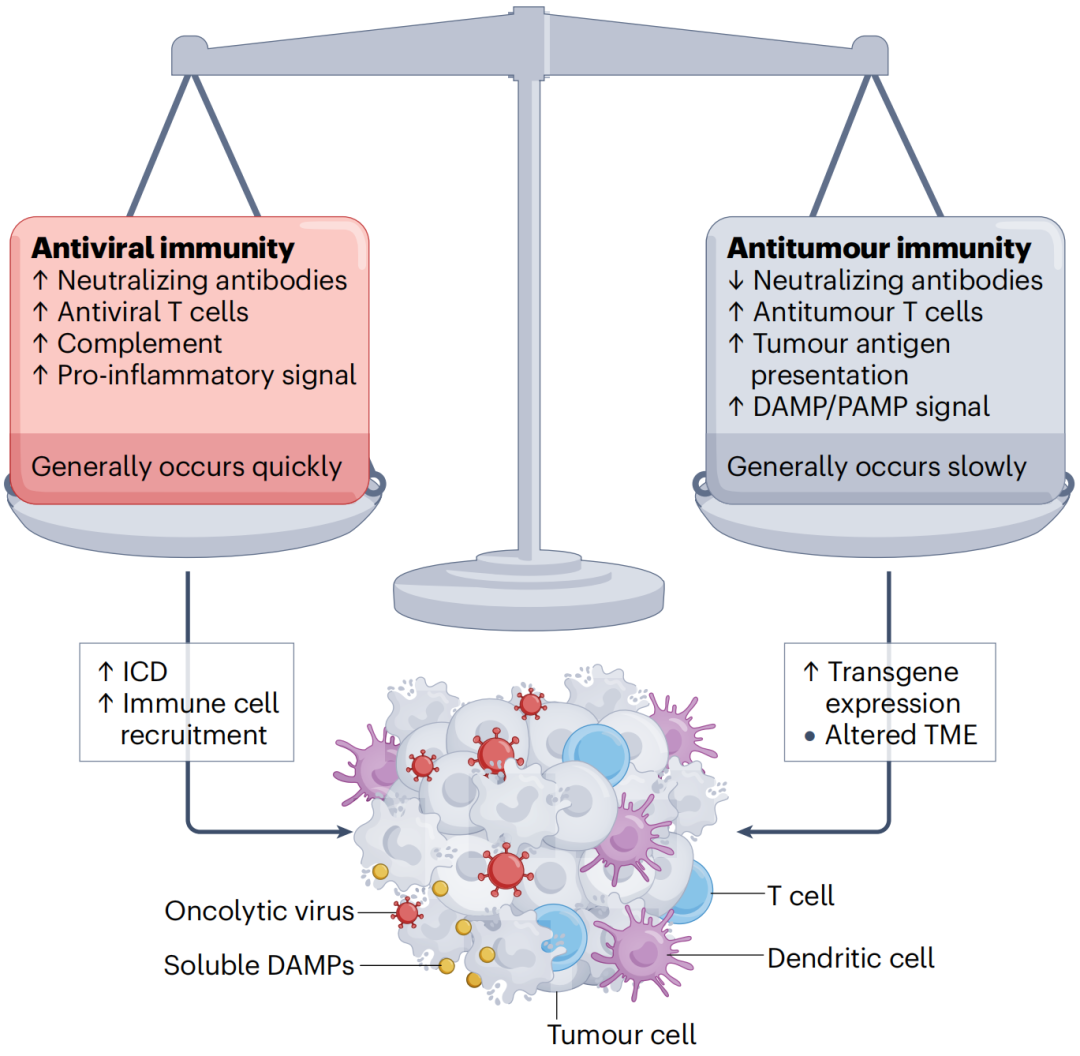
图4 抗病毒免疫和抗肿瘤免疫之间的平衡
4.1.4 减少抗病毒免疫的策略
目前正在尝试新的策略减少接受OVs治疗的患者抗病毒免疫的发生率。例如,使用细胞衍生的纳米囊泡、脂质体或化学聚合物的保护涂层(protective coatings),来保护OVs免受被动或主动免疫成分的影响。这种保护涂层还可以添加特定的癌症靶向配体,使OVs能够特异性地靶向肿瘤细胞。虽然这种方法为OVs疗法来带希望,但储存和保持稳定较困难,且制造成本高。
另一种策略是使用体外负载OVs的细胞,然后将这种细胞注射进患者体内。OVs的细胞载体通常来源于肿瘤浸润免疫细胞,如树突状细胞、T细胞、间充质干细胞和巨噬细胞,因为这些细胞都可以自然地迁移到肿瘤生长部位。但对致瘤性的担忧可能会限制此方法未来的临床发展。目前有两项临床研究(NCT03896568和NCT02068794)均使用间充质干细胞作为递送载体。
4.1.5 瘤内给药的重大挑战
大多数OVs需要瘤内给药,这给临床开发带来了另一个重大挑战。明确肿瘤内给药后OVs的最佳生物分布和药代动力学/药效学的药理学研究,是目前该领域的研究重点。此外在肿瘤细胞内的病毒复制、非恶性细胞中的无复制、患者体液中病毒脱落的检测、潜伏感染的存在、抗病毒免疫和抗肿瘤免疫反应等参数方面仍需进行标准化评估和量化。彻底评估这些指标需要开发用于临床试验的标准化检测和终点。迄今为止,OVs的给药策略很大程度上是经验性的,仍缺乏基于体重的给药与基于肿瘤体积的给药性能的研究数据。同样,OVs的最佳剂量、病毒递送的时机尚不清楚,这些因素对于适当的临床研究设计至关重要。
4.1.6 OVs的生物标志物的发现和临床验证
当前,我们对OVs先天和获得性耐药机制的了解有限,直接注射的肿瘤与未注射的病变之间可能存在差异。此外,能更好地选择OVs治疗患者的预测性生物标志物尚处于开发的早期阶段。在2021年发表的一项研究中,含有JAK1/2功能缺失突变的肿瘤对ICIs具有耐药性,尽管与JAK1/2野生型细胞相比,这些病变来源的细胞在暴露于HSV1和VSV时病毒复制增强。缺失JAK信号可能会干扰抗病毒免疫反应,这解释了为什么OVs在JAK缺失的肿瘤细胞中似乎更具相容性。这些研究的数据表明,与细胞内抗病毒活性相关的因素可能是OV反应的潜在生物标志物,这需要进一步的临床验证。其他值得进一步探索的OVs活性潜在生物标志物包括肿瘤内在因素,如肿瘤突变负担、炎症/抗病毒基因表达和肿瘤细胞PD-L1表达,所有这些都已经被作为其他免疫疗法在选定癌症中的生物标志物中进行了研究。免疫系统相关因素,如肿瘤浸润淋巴细胞,以及系统因素,如循环肿瘤DNA和外泌体,也应作为前瞻性临床试验的潜在生物标志物进行探索。
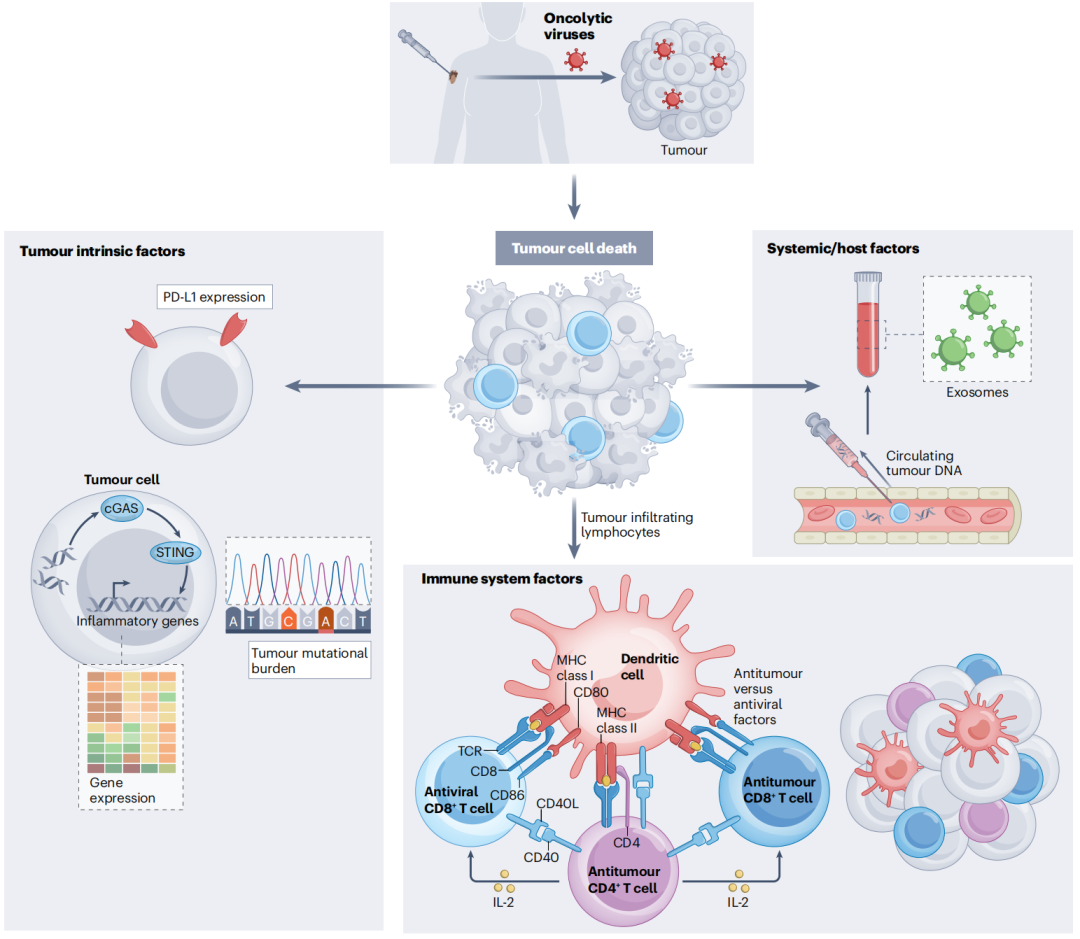
图5 OVs的生物标志物的发现
(图片来源:Shalhout SZ et al., Nat Rev Clin Oncol, 2023)
4.2 临床挑战
OVs通常具有可耐受的安全性,但OVs仍然是可复制的活病毒,在临床使用时需要考虑病毒脱落和无意传染给医护人员、患者家属和排入环境中的风险。需要注意OVs的储存、准备和使用等环节,正确处理被污染的绷带和其他医疗废弃物。需要制定指南和发展计划,概述溶瘤病毒安全储存、处理和使用的规程,以及如何处理意外泄漏、过量注射和对注射部位消毒的政策。同时还需加强对医护人员的培训。
临床医生应意识到,在接受T-VEC或其他OVs治疗的患者中,延迟反应可能普遍存在。在这种情况下,可能会出现新的病灶,或者原有的病灶在测量时直径增加,这是由于局部炎症和/或免疫细胞的积聚形成的假性进展,并非真正的肿瘤细胞增殖。因此,如果肿瘤大小保持稳定或疑似延迟反应,可以进行活检以区分肿瘤生长和炎症反应。
瘤内注射是临床应用OVs的主要障碍,目前越来越多的临床前数据支持静脉注射。这种方法理论上能使OVs广泛感染所有病灶,同时也避免了复杂的定位设备。有研究已经证实静脉注射OVs的安全性,并在切除的肿瘤标本中检测到OVs的存在,说明OVs的静脉注射具有明显的优势。然而,也需要考虑几个缺点。首先,静脉注射OVs的最佳剂量尚不清楚,因为病毒会被稀释在外周循环中,使得任何单个肿瘤部位的生物利用滴度无法预测。另外病毒颗粒可能被循环中的抗体或补体过早清除,可能会降低到达病变处的有效病毒剂量。因此,需要进一步特定OVs进入全身循环后的药代动力学。
4.3 监管挑战
OVs的批准仍会受到监管方面的挑战。与大多数抗癌治疗药物相比,OVs的独特性体现在两方面。首先,它是可复制的活病毒。其次,大多数OVs采用瘤内注射的方式。这些因素使得许多建立临床试验终点、药代动力学、剂量和方案的传统方法不适用于OVs的评估。在缺乏临床前数据的情况下,大部分临床开发都是经验性的。
明确特定的给药剂量极具挑战,研究人员应考虑多个因素,包括基于当前的良好生产规范(good manufacturing practices,GMP)能达到的最大浓度、生产能力、病毒免疫原性、预先存在的中和抗病毒抗体的可能性、肿瘤组织学和其他转基因表达的影响。其他需要考虑的因素还应包括是否应当根据肿瘤体积调整剂量,以及根据病毒致病性确定最大安全日剂量等。此外,还需注意选择最适合注射的病灶,并应考虑根据特定病毒的潜在致病性和免疫原性制定适当的纳入和排除标准。
在临床中,考虑到延迟反应的可能性,在评估OV抗肿瘤活性时需要仔细设计,选取合适的临床试验终点和对照。
5. 有前景的新型OVs
目前,在实体瘤中有几种OVs处于临床开发的后期阶段。
5.1 神经胶质瘤
恶性胶质瘤是最具侵袭性的癌症之一,有效的治疗方案很少。患者通常接受减瘤手术后再进行放化疗。尽管如此,中位OS仍然只有15个月左右。胶质瘤一般局限于中枢神经系统,且胶质瘤细胞易被病毒感染(包括HSV1、腺病毒和脊髓灰质炎病毒),因此,OVs是一种合适的治疗选择。
Teserpaturev是基于HSV-1开发的第三代OV产品,在日本被批准用于治疗恶性胶质瘤患者。一项单臂Ⅱ期试验的结果显示,复发性和/或残留胶质母细胞瘤患者的1年OS为84.2%。在这项研究中,Teserpaturev总体上耐受性良好,最常见的不良事件是发热、呕吐、恶心和白细胞减少。此外,溶瘤HSV1毒株G207也正在研究中,用于治疗胶质瘤。该药物在12例高级别胶质瘤的患儿中进行了评估,结果仅出现1级不良事件。大部分患者病情(11/12)都得到缓解,中位OS为12.2个月。另外值得注意的是,rQNestin34.5v.2这种经基因工程改造的HSV1溶瘤病毒,与环磷酰胺联合治疗复发性恶性胶质瘤患者的研究正在进行中(NCT03152318)。截至目前,在接受该药物治疗的胶质母细胞瘤患者的血清中检测到了IL-10和CCL2,这可能表明免疫抑制微环境的形成。然而,在小鼠模型中,NOTCH信号的药理抑制已被证明可以挽救rQNestin34.5引起的免疫抑制。
Tasadenoturev是一种基于5型腺病毒的OV,已在12名患有弥漫性内生型桥脑胶质瘤的患儿(中位年龄为9岁)中进行了评估。在75%的患儿中观察到肿瘤直径明显缩小。报告了3起严重不良事件,包括3级头痛和肌肉无力,中位OS为17.8个月。在37名患有复发性恶性胶质瘤的成年患者队列中进一步评估了Tasadenoturev的安全性和有效性。在长期疗效分析中,20%的患者在治疗后3年仍然存活,其中3名患者接近完全缓解(肿瘤物质减少约95%)。只有2名患者出现与治疗相关的不良事件,所有事件的严重程度均为1-2级,并未观察到剂量限制性毒性。
5.2 膀胱癌
膀胱内注射卡介苗(bacillus calmette guerin,BCG)是中危和高危非肌层浸润性膀胱癌(non muscle-invasive bladder cancer,NMIBC)患者术后的标准辅助疗法。目前,几种腺病毒治疗BCG难治性NMIBC患者的临床研究正在进行中。CG0070是一种基于5型腺病毒的OV,编码GM-CSF,已在一项临床Ⅰ/Ⅱ期试验中进行了评估。结果显示,在接受一次或多次膀胱内输注的35名患者中,有效剂量的完全缓解率为48.6%,中位缓解时间为10.4个月。Ⅱ期试验纳入了45名BCG难治性NMIBC患者,CG0070的6个月完全缓解率为47%。CG0070耐受性良好,最常报告的治疗相关不良事件包括膀胱痉挛、血尿和排尿困难。尿路感染是最常见的治疗相关感染性事件(占患者的16%),其他可能与OVs相关的事件包括流感样症状和疲劳。CG0070联合pembrolizumab治疗类似患者的临床试验也正在进行中,期中分析报告了积极的结果(NCT04387461)。
Nadofaragene firadenovec是一种复制缺陷型非溶瘤腺病毒,能够将基因递送到尿路上皮细胞,特别是编码人IFNA2B基因的cDNA。2021年,开展了一项关于Nadofaragene firadenovec在BCG难治性NMIBC患者中的安全性和疗效的Ⅲ期多中心研究。在这项研究中,157名患者接受了单次膀胱内注射3×1011vp/mL Nadofaragene firadenovec。总体而言,53.4%的患者在首次给药后3个月内达到完全缓解,45.5%的患者在12个月内持续缓解。最常见的3级不良事件是2名患者(1%)出现尿急。基于这些数据,FDA于2022年12月批准膀胱内灌注Nadofaragene firadenovec治疗BCG无反应的NMIBC。
5.3 其他癌症
Seprehvir是一种基于HSV1716的OV,目前正在一项Ⅰ/Ⅱ期试验中,对晚期实体瘤的儿童和年轻人(11-30岁)进行评估。初步数据显示没有剂量限制性毒性。另一种基于HSV1的OV产品HF10正在与ipilimumab联合评估,用于治疗转移性或不可切除的黑色素瘤患者。初步报告显示,HF10耐受性良好,大多数不良事件的严重程度≤2级。3名患者出现了与HF10相关的≥3级不良事件(栓塞、淋巴水肿和腹泻)。24周的ORR为41%,68%的患者病情稳定。中位PFS为19个月,中位总OS为21.8个月。HF10也在晚期皮肤实体瘤患者中显示出耐受性良好。
在其他基于HSV1的OVs中,正在评估RP1(编码GM-CSF和长臂猿白血病病毒包膜糖蛋白的融合形式,可促进病毒的局部传播)与ICI联合治疗皮肤鳞状细胞癌(NCT04050436)以及黑色素瘤和非黑色素瘤皮肤癌患者的疗效。同样,ONCR-177目前也在Ⅰ期试验中,以评估其与pembrolizumab联合治疗晚期或转移性实体瘤患者的疗效(NCT04348916)。
呼肠孤病毒是一种普遍存在的双链RNA病毒。大多数人由于接触过这类病毒而产生抗体。然而,过表达EGFR或激活RAS信号通路的癌细胞易受呼肠孤病毒感染。Reolysin是一种溶瘤呼肠孤病毒,已在多项针对不同适应症的临床试验中进行了评估,显示出良好的抗肿瘤活性和较好的安全性。一项Ⅰb期临床试验评估了静脉注射Reolysin联合pembrolizumab+化疗在晚期胰腺癌患者中的安全性和耐受性。在10名可评估的患者中,观察到3名患者的病情得到控制,其中1名患者达到PR且持续了17.4个月。只有2名患者出现了≥3级的不良事件。
总结
OVs作为抗癌疗法前景广阔。基于T-VEC临床试验和真实世界研究的支持性数据,及OVs可接受的安全性和不与其他疗法重叠的作用机制,为肿瘤治疗领域带来了新的希望。许多其他有前景的OVs也正在临床开发中,为了更好地了解OVs的生物学和免疫学特点,研究者们正在努力探索新的OVs策略和潜在的预测生物标志物。此外,监管机构、科学家、临床医生以及工业界之间应加强合作,以更好的选择患者和设计研究,从而充分发挥出OVs在肿瘤治疗领域的潜力,使患者获益最大化。
劲帆业务
溶瘤病毒疗法是肿瘤免疫疗法的一个重要分支,已被充分证实在肿瘤治疗领域具有广阔的应用前景。劲帆医药可提供多种溶瘤腺病毒载体的改造和开发,包括单纯疱疹病毒(HSV)、牛痘病毒(VV)、腺病毒(AdV)、呼长弧病毒(reovirus)以及水疱性口炎病毒(VSV)。我们拥有成熟的重组病毒技术研究平台,拥有完备且经验丰富的工艺开发、生产、质量研究团队,6400m2 cGMP车间已建成,含4个P2级别种子建库区、5条病毒生产线和1条灌装生产线,可实现临床级病毒载体规模化生产。欢迎添加劲帆BD商务团队详询溶瘤病毒产品CDMO解决方案。
原文链接:https://www.nature.com/articles/s41571-022-00719-w

地址:中国武汉东湖高新区光谷七路128号 市场:17720522078 人事行政:027-62439686 邮箱:marketing@genevoyager.com
BD 商务总台:17720514121 /13886000399(BD 经理) /17720515371(BD 经理)
本公司所有产品仅供实验科研使用,不用于人体疾病治疗及临床诊断。